Page 95 - Dys
P. 95
95
поверхневих плівок, через що різко підвищується опір сталі корозійно-
статичному руйнуванню (табл. 4.3).
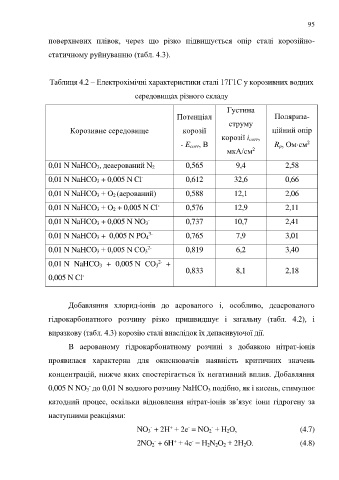
Таблиця 4.2 – Електрохімічні характеристики сталі 17Г1С у корозивних водних
середовищах різного складу
Густина
Потенціал Поляриза-
струму
Корозивне середовище корозії ційний опір
корозії i corr,
2
- E corr, В R p, Омcм
мкА/cм
2
0,01 N NaHCO 3, деаерований N 2 0,565 9,4 2,58
-
0,01 N NaHCO 3 + 0,005 N Cl 0,612 32,6 0,66
0,01 N NaHCO 3 + О 2 (аерований) 0,588 12,1 2,06
-
0,01 N NaHCO 3 + О 2 + 0,005 N Cl 0,576 12,9 2,11
-
0,01 N NaHCO 3 + 0,005 N NO 3 0,737 10,7 2,41
0,01 N NaHCO 3 + 0,005 N PO 4 0,765 7,9 3,01
3-
2-
0,01 N NaHCO 3 + 0,005 N СО 3 0,819 6,2 3,40
2-
0,01 N NaHCO 3 + 0,005 N СО 3 +
0,833 8,1 2,18
-
0,005 N Cl
Добавляння хлорид-іонів до аерованого і, особливо, деаерованого
гідрокарбонатного розчину різко пришвидшує і загальну (табл. 4.2), і
виразкову (табл. 4.3) корозію сталі внаслідок їх депасивуючої дії.
В аерованому гідрокарбонатному розчині з добавкою нітрат-іонів
проявилася характерна для окиснювачів наявність критичних значень
концентрацій, нижче яких спостерігається їх негативний вплив. Добавляння
-
0,005 N NO 3 до 0,01 N водного розчину NaHCO 3 подібно, як і кисень, стимулює
катодний процес, оскільки відновлення нітрат-іонів зв’язує іони гідрогену за
наступними реакціями:
-
-
-
+
NO 3 + 2H + 2е = NO 2 + Н 2О, (4.7)
-
+
2NO 2 + 6H + 4е = Н 2N 2O 2 + 2Н 2О. (4.8)
-