Page 92 - Dys
P. 92
92
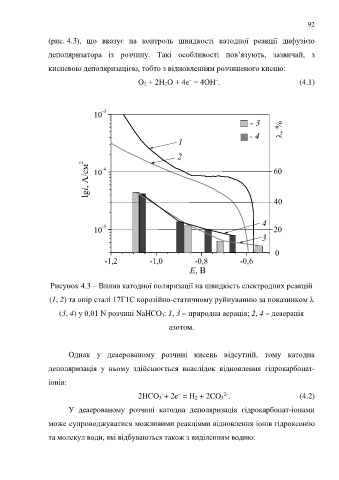
(рис. 4.3), що вказує на контроль швидкості катодної реакції дифузією
деполяризатора із розчину. Такі особливості пов’язують, зазвичай, з
кисневою деполяризацією, тобто з відновленням розчиненого кисню:
О 2 + 2Н 2О + 4е = 4ОН . (4.1)
–
–
10 -3
- 3
- 4 , %
1
2
lgi, A/cм 2 10 -4 60
40
4
10 -5 20
3
0
-1,2 -1,0 -0,8 -0,6
E, В
Рисунок 4.3 – Вплив катодної поляризації на швидкість електродних реакцій
(1, 2) та опір сталі 17Г1С корозійно-статичному руйнуванню за показником λ
(3, 4) у 0,01 N розчині NaHCO 3: 1, 3 – природна аерація; 2, 4 – деаерація
азотом.
Однак у деаерованому розчині кисень відсутній, тому катодна
деполяризація у ньому здійснюється внаслідок відновлення гідрокарбонат-
іонів:
–
–
2HCO 3 + 2e = H 2 + 2CO 3 . (4.2)
2–
У деаерованому розчині катодна деполяризація гідрокарбонат-іонами
може супроводжуватися можливими реакціями відновлення іонів гідроксонію
та молекул води, які відбуваються також з виділенням водню: