Page 172 - Korniy_dyser
P. 172
172
іонізованих атомів (або їх комплексів) на рівень Фермі металу. Таким чином,
якщо зв’язок іонізованого атома з металом розривається, поверхня металу
більше не відповідальна за перенесення заряду та зв’язок з молекулами води,
і перенесений заряд тепер зберігається тільки на атомі алюмінію, в результаті
чого заряд збільшується. Розрахунки підтверджують те, що анодне розчинен-
ня поверхні металу починається з іонізації атомів, а потім відбувається
перенесення атому металу в розчин з утворенням іона металічного
комплексу.
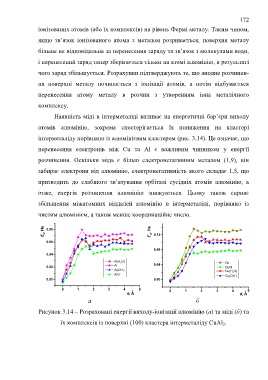
Наявність міді в інтерметаліді впливає на енергетичні бар’єри виходу
атомів алюмінію, зокрема спостерігається їх пониження на кластері
інтерметаліду порівняно із алюмінієвим кластером (рис. 3.14). Це означає, що
перенесення електронів між Сu та Al є важливим чинником у енергії
розчинення. Оскільки мідь є більш електронегативним металом (1,9), він
забирає електрони від алюмінію, електронегативність якого складає 1,5, що
призводить до слабшого зв’язування орбіталі сусідніх атомів алюмінію, а
отже, енергія розчинення алюмінію знижуються. Цьому також сприяє
збільшення міжатомних віддалей алюмінію в інтерметаліді, порівняно із
чистим алюмінієм, а також менше координаційне число.
E d , Ha 0.08 E d , Ha 0.12
0.06
0.08
0.04
Al(H O)
2 Cu
Al 0.04
0.02 CuCl -
Al(OH ) - Cu(H O)
- 2
AlCl -
Cu(OH )
0.00 0.00
0 1 2 3 4 o 5 0 1 2 3 4 o 5
d, A d, A
а б
Рисунок 3.14 – Розраховані енергії виходу-іонізації алюмінію (а) та міді (б) та
їх комплексів із поверхні (100) кластера інтерметаліду CuAl 2.