Page 175 - Korniy_dyser
P. 175
175
випадку катодні та анодні реакції будуть протікати, переважно, на невеликих
групах атомів окремих компонентів.
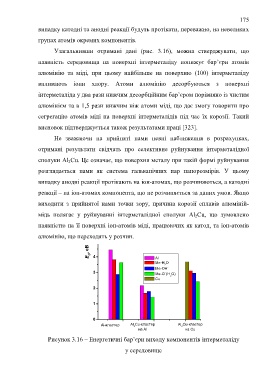
Узагальнивши отримані дані (рис. 3.16), можна стверджувати, що
наявність середовища на поверхні інтерметаліду понижує бар’єри атомів
алюмінію та міді, при цьому найбільше на поверхню (100) інтерметаліду
впливають іони хлору. Атоми алюмінію десорбуються з поверхні
інтерметаліда у два рази нижчим десорбційним бар’єром порівняно із чистим
алюмінієм та в 1,5 рази нижчим ніж атоми міді, що дає змогу говорити про
сегрегацію атомів міді на поверхні інтерметалідів під час їх корозії. Такий
висновок підтверджується також результатами праці [323].
Не зважаючи на прийняті нами певні наближення в розрахунках,
отримані результати свідчать про селективне руйнування інтерметалідної
сполуки Аl 2Сu. Це означає, що поверхня металу при такій формі руйнування
розглядається нами як система гальванічних пар нанорозмірів. У цьому
випадку анодні реакції протікають на іон-атомах, що розчиняються, а катодні
реакції – на іон-атомах компонента, що не розчиняється за даних умов. Якщо
виходити з прийнятої нами точки зору, причина корозії сплавів алюміній-
мідь полягає у руйнуванні інтерметалідної сполуки Аl 2Сu, що зумовлено
наявністю на її поверхні іон-атомів міді, працюючих як катод, та іон-атомів
алюмінію, що переходять у розчин.
E D , еВ 4
Al
Me-H O
2
Me-OH -
3 Me-Cl (H O)
-
2
Cu
2
1
0
Al-кластер Al Cu-кластер Al Cu-кластер
2
2
на Al на Cu
Рисунок 3.16 – Енергетичні бар’єри виходу компонентів інтерметаліду
у середовище