Page 174 - Korniy_dyser
P. 174
174
зв’язку. Отриманий результат можна пояснити також тим, що в момент
виникнення металічного комплексу під час анодної іонізації мають місце
ефекти часткового переносу заряду, зумовлені ковалентним характером
взаємодії центрального атома комплексу з поверхнею кластера через
молекули води. Відмітимо, що у всіх випадках середовище понижує
десорбційні бар’єри атомів алюмінію та міді в ряді: молекули води → іони
гідроксиду → хлоридні комплекси.
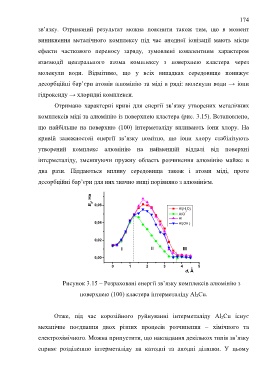
Отримано характерні криві для енергії зв’язку утворених металічних
комплексів міді та алюмінію із поверхнею кластера (рис. 3.15). Встановлено,
що найбільше на поверхню (100) інтерметаліду впливають іони хлору. На
кривій залежностей енергії зв’язку помітно, що іони хлору стабілізують
утворений комплекс алюмінію на найменшій віддалі від поверхні
інтерметаліду, зменшуючи пружну область розчинення алюмінію майже в
два рази. Піддаються впливу середовища також і атоми міді, проте
десорбційні бар’єри для них значно вищі порівняно з алюмінієм.
E b , Ha
0,06
Al(H O)
2
-
AlCl
Al
0,04 Al(OH ) -
0,02
I II III
0,00
0 1 2 3 4 o 5
d, A
Рисунок 3.15 – Розраховані енергії зв’язку комплексів алюмінію з
поверхнею (100) кластера інтерметаліду Al 2Cu.
Отже, під час корозійного руйнуванні інтерметаліду Al 2Cu існує
механічне поєднання двох різних процесів розчинення – хімічного та
електрохімічного. Можна припустити, що накладання декількох типів зв’язку
сприяє розділенню інтерметаліду на катодні та анодні ділянки. У цьому