Page 96 - Дисертація_Влад_Христина_Ігорівна
P. 96
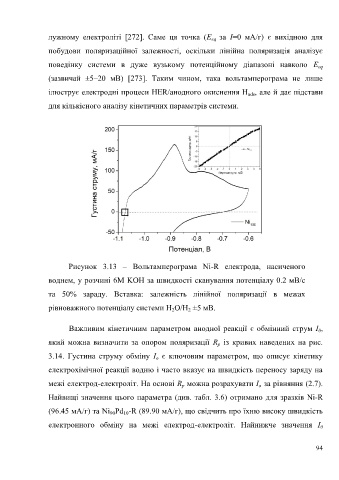
лужному електроліті [272]. Саме ця точка (E за I=0 мА/г) є вихідною для
eq
побудови поляризаційної залежності, оскільки лінійна поляризація аналізує
поведінку системи в дуже вузькому потенційному діапазоні навколо E eq
(зазвичай ±5–20 мВ) [273]. Таким чином, така вольтамперограма не лише
ілюструє електродні процеси HER/анодного окиснення H , але й дає підстави
ads
для кількісного аналізу кінетичних параметрів системи.
Рисунок 3.13 – Вольтамперограма Ni-R електрода, насиченого
воднем, у розчині 6М KOH за швидкості сканування потенціалу 0.2 мВ/с
та 50% зараду. Вставка: залежність лінійної поляризації в межах
рівноважного потенціалу системи H O/H ±5 мВ.
2
2
Важливим кінетичним параметром анодної реакції є обмінний струм І ,
0
який можна визначити за опором поляризації R із кривих наведених на рис.
p
3.14. Густина струму обміну І є ключовим параметром, що описує кінетику
о
електрохімічної реакції водню і часто вказує на швидкість переносу заряду на
межі електрод-електроліт. На основі R можна розрахувати І за рівняння (2.7).
p
о
Найвищі значення цього параметра (див. табл. 3.6) отримано для зразків Ni-R
(96.45 мА/г) та Ni Pd -R (89.90 мА/г), що свідчить про їхню високу швидкість
90
10
електронного обміну на межі електрод-електроліт. Найнижче значення І 0
94