Page 94 - Дисертація_Влад_Христина_Ігорівна
P. 94
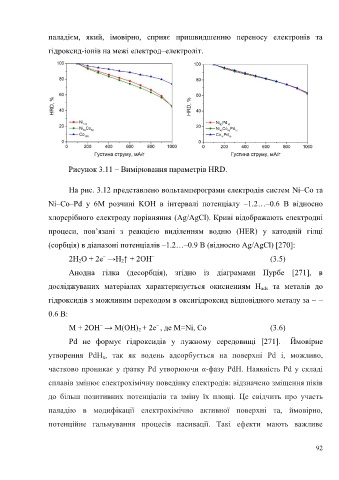
паладієм, який, імовірно, сприяє пришвидшенню переносу електронів та
гідроксид-іонів на межі електрод–електроліт.
Рисунок 3.11 – Вимірювання параметрів HRD.
На рис. 3.12 представлено вольтамперограми електродів систем Ni–Co та
Ni–Co–Pd у 6M розчині KOH в інтервалі потенціалу –1.2…–0.6 В відносно
хлорсрібного електроду порівняння (Ag/AgCl). Криві відображають електродні
процеси, пов’язані з реакцією виділенням водню (HER) у катодній гілці
(сорбція) в діапазоні потенціалів –1.2…–0.9 В (відносно Ag/AgCl) [270]:
–
–
2H O + 2e →H ↑ + 2OH (3.5)
2
2
Анодна гілка (десорбція), згідно із діаграмами Пурбе [271], в
досліджуваних матеріалах характеризується окисненням H та металів до
ads
гідроксидів з можливим переходом в оксигідроксид відповідного металу за ⁓ –
0.6 В:
–
–
М + 2OH → M(OH) + 2e , де M=Ni, Co (3.6)
2
. Ймовірне
Pd не формує гідроксидів у лужному середовищі [271].
утворення PdH , так як водень адсорбується на поверхні Pd і, можливо,
x
частково проникає у ґратку Pd утворюючи α-фазу PdH. Наявність Pd у складі
сплавів змінює електрохімічну поведінку електродів: відзначено зміщення піків
до більш позитивних потенціалів та зміну їх площі. Це свідчить про участь
паладію в модифікації електрохімічно активної поверхні та, ймовірно,
потенційне гальмування процесів пасивації. Такі ефекти мають важливе
92