Page 244 - Korniy_dyser
P. 244
244
–
кластерів майже на 9%, тоді як корозійно активні іони Cl підвищують W А у
1,3…3,8 разів.
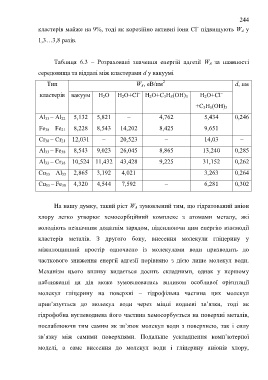
Таблиця 6.3 – Розраховані значення енергій адгезії W А за наявності
середовища та віддалі між кластерами d у вакуумі
2
Тип W А, еВ/нм d, нм
кластерів вакуум H 2O H 2O+Cl – H 2O+C 3H 5(OH) 3 H 2O+Cl –
+C 3H 5(OH) 3
Al 33 – Al 22 5,132 5,821 – 4,762 5,434 0,246
Fe 38 – Fe 21 8,228 8,543 14,202 8,425 9,651 –
Cr 38 – Cr 21 12,031 – 20,523 – 14,03 –
Al 33 – Fe 38 8,543 9,023 26,045 8,865 13,240 0,285
Al 33 – Cr 38 10,524 11,432 43,428 9,225 31,152 0,262
Cu 33 – Al 33 2,865 3,192 4,021 – 3,263 0,264
Cu 33 – Fe 38 4,320 4,544 7,592 – 6,281 0,302
На нашу думку, такий ріст W А зумовлений тим, що гідратований аніон
хлору легко утворює хемосорбційний комплекс з атомами металу, які
володіють незначним додатнім зарядом, підсилюючи цим енергію взаємодії
кластерів металів. З другого боку, внесення молекули гліцерину у
міжплощинний простір одночасно із молекулами води призводить до
часткового зниження енергії адгезії порівняно з дією лише молекул води.
Механізм цього впливу видається досить складними, однак у першому
наближенні ця дія може зумовлюватись впливом особливої орієнтації
молекул гліцерину на поверхні – гідрофільна частина цих молекул
прив’язується до молекул води через міцні водневі зв’язки, тоді як
гідрофобна вуглеводнева його частина хемосорбується на поверхні металів,
послаблюючи тим самим як зв’язок молекул води з поверхнею, так і силу
зв’язку між самими поверхнями. Подальше ускладнення комп’ютерної
моделі, а саме внесення до молекул води і гліцерину аніонів хлору,