Page 165 - Korniy_dyser
P. 165
165
віддаль Cu–Cu є досить великою – 4,27 Å. Енергія зв’язку збільшується за
рахунок утворення зв’язків не лише з алюмінієм але й атомами міді.
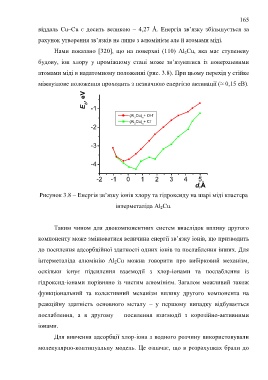
Нами показано [320], що на поверхні (110) Al 2Cu, яка має ступеневу
будову, іон хлору у проміжному стані може зв’язуватися із поверхневими
атомами міді в надатомному положенні (рис. 3.8). При цьому перехід у стійке
міжвузлове положення проходить з незначною енергією активації (≈ 0,15 eВ).
E b , eV
-1
(Al Cu) + OH -
2 n
-
(Al Cu) + Cl
2 n
-2
-3
-4
-2 -1 0 1 2 3 4 5 o
d,A
Рисунок 3.8 – Енергія зв’язку іонів хлору та гідроксиду на шарі міді кластера
інтерметаліда Al 2Cu.
Таким чином для двокомпонентних систем внаслідок впливу другого
компоненту може змінюватися величина енергії зв’язку іонів, що призводить
до посилення адсорбційної здатності одних іонів та послаблення інших. Для
інтерметаліда алюмінію Al 2Cu можна говорити про вибірковий механізм,
оскільки існує підсилення взаємодії з хлор-іонами та послаблення із
гідроксид-іонами порівняно із чистим алюмінієм. Загалом можливий також
функціональний та колективний механізм впливу другого компонента на
реакційну здатність основного металу – у першому випадку відбувається
послаблення, а в другому – посилення взаємодії з корозійно-активними
іонами.
Для вивчення адсорбції хлор-іона з водного розчину використовували
молекулярно-континуальну модель. Це означає, що в розрахунках брали до