Page 161 - Korniy_dyser
P. 161
161
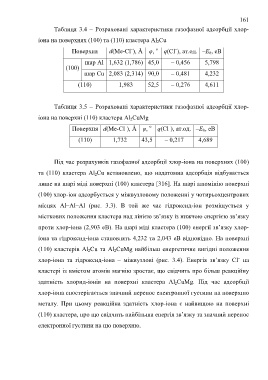
Таблиця 3.4 – Розраховані характеристики газофазної адсорбції хлор-
іона на поверхнях (100) та (110) кластера Al 2Cu
–
–
Поверхня d(Me-Cl ), Å φ, о q(Cl ), ат.од. –E b, еВ
шар Al 1,632 (1,786) 45,0 – 0,456 5,798
(100)
шар Cu 2,083 (2,314) 90,0 – 0,481 4,232
(110) 1,983 52,5 – 0,276 4,611
Таблиця 3.5 – Розраховані характеристики газофазної адсорбції хлор-
іона на поверхні (110) кластера Al 2CuMg
–
–
Поверхня d(Me-Cl ), Å φ, о q(Cl ), ат.од. –E b, еВ
(110) 1,732 43,5 – 0,217 4,689
Під час розрахунків газофазної адсорбції хлор-іона на поверхнях (100)
та (110) кластера Al 2Cu встановлено, що надатомна адсорбція відбувається
лише на шарі міді поверхні (100) кластера [316]. На шарі алюмінію поверхні
(100) хлор-іон адсорбується у міжвузловому положенні у чотирьохцентрових
місцях Al–Al–Al (рис. 3.3). В той же час гідроксид-іон розміщується у
місткових положення кластера над лінією зв’язку із нижчою енергією зв’язку
проти хлор-іона (2,903 еВ). На шарі міді кластера (100) енергії зв’язку хлор-
іона та гідроксид-іона становлять 4,232 та 2,043 еВ відповідно. На поверхні
(110) кластерів Al 2Cu та Al 2CuMg найбільш енергетичне вигідні положення
–
хлор-іона та гідроксид-іона – міжвузлові (рис. 3.4). Енергія зв’язку Cl на
кластері із вмістом атомів магнію зростає, що свідчить про більш реакційну
здатність хлорид-іонів на поверхні кластера Al 2CuMg. Під час адсорбції
хлор-іона спостерігається значний перенос електронної густини на поверхню
металу. При цьому реакційна здатність хлор-іона є найвищою на поверхні
(110) кластера, про що свідчить найбільша енергія зв’язку та значний перенос
електронної густини на цю поверхню.