Page 289 - Korniy_dyser
P. 289
289
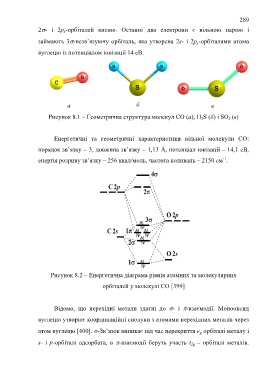
2- і 2р x-орбіталей кисню. Останні два електрони є вільною парою і
займають 3-незв’язуючу орбіталь, яка утворена 2s- і 2p x-орбіталями атома
вуглецю із потенціалом іонізації 14 еВ.
а б в
Рисунок 8.1 – Геометрична структура молекул СО (а), H 2S (б) і SO 2 (в)
Енергетичні та геометричні характеристики вільної молекули СО:
порядок зв’язку – 3, довжина зв’язку – 1,13 Å, потенціал іонізації – 14,1 еВ,
-1
енергія розриву зв’язку – 256 ккал/моль, частота коливань – 2150 см .
Рисунок 8.2 – Енергетична діаграма рівнів атомних та молекулярних
орбіталей у молекулі СО [399]
Відомо, що перехідні метали здатні до - і -взаємодії. Монооксид
вуглецю утворює координаційні сполуки з атомами перехідних металів через
атом вуглецю [400]. -Зв’язок виникає під час перекриття e g орбіталі металу і
s- і p-орбіталі адсорбата, в -взаємодії беруть участь t 2g – орбіталі металів.