Page 225 - Korniy_dyser
P. 225
225
агресивних середовищ на поверхні металів. Цеоліти, які містять у своєму
складі надлишок іонів кальцію, більш схильні до сорбції іонів водню і таким
чином можуть запобігати проникненню цих іонів до поверхні металу,
сповільнюючи процес корозійного руйнування [365].
Нами розраховано також енергії активації взаємодії іонів металів
середовища з адсорбційними центрами, якими у нашому випадку можуть
виступати поверхневі атоми кисню із спареними електронними парами (табл.
5.6) Розраховано два типи такої взаємодії, а саме – адсорбцію і утворення
хемосорбційного зв’язку. Крім цього, згідно теорії електролітів необхідно
було розглянути взаємодію чистих та гідратованих однією молекулою води
(у першому наближенні) іонів водню та металів – кальцію, цинку, магнію,
стронцію, кадмію, міді і заліза.
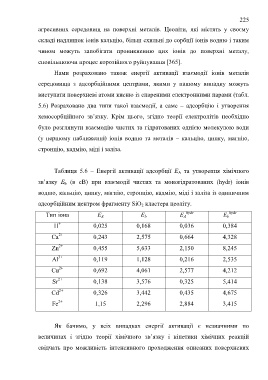
Таблиця 5.6 – Енергії активації адсорбції Е А та утворення хімічного
зв’язку Е b (в еВ) при взаємодії чистих та моногідратованих (hydr) іонів
водню, кальцію, цинку, магнію, стронцію, кадмію, міді і заліза із одиничним
адсорбційним центром фрагменту SiO 2 кластера цеоліту.
Тип іона Е А Е b Е А hydr Е b hydr
+
H 0,025 0,168 0,036 0,384
2+
Ca 0,243 2,575 0,664 4,328
2+
Zn 0,455 5,633 2,150 8,245
3+
Al 0,119 1,128 0,216 2,535
2+
Cu 0,692 4,061 2,577 4,212
2+
Sr 0,138 3,576 0,325 5,414
2+
Cd 0,326 3,442 0,435 4,675
2+
Fe 1,15 2,296 2,884 3,415
Як бачимо, у всіх випадках енергії активації є незначними по
величинах і згідно теорії хімічного зв’язку і кінетики хімічних реакцій
свідчать про можливість інтенсивного проходження описаних поверхневих