Page 9 - НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
P. 9
7
суттєво вища частка феритних зерен та великі перлітні зерна, що зумовлює її вищу ЕХ
гетерогенність, а отже, нижчий опір корозії.
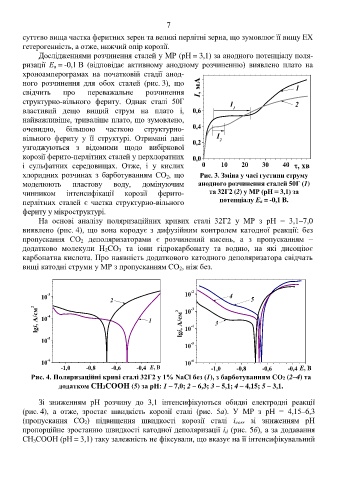
Дослідженнями розчинення сталей у МР (рН = 3,1) за анодного потенціалу поля-
ризації Е а = -0,1 В (відповідає активному анодному розчиненню) виявлено плато на
хроноамперограмах на початковій стадії анод-
ного розчинення для обох сталей (рис. 3), що 1,0
свідчить про переважальне розчинення 0,8 І, мА 1
структурно-вільного фериту. Однак сталі 50Г І 2
властивий дещо вищий струм на плато і, 0,6 1
найважливіше, триваліше плато, що зумовлено,
очевидно, більшою часткою структурно- 0,4
вільного фериту у її структурі. Отримані дані І 2
узгоджуються з відомими щодо вибіркової 0,2
корозії ферито-перлітних сталей у перхлоратних 0,0
50
і сульфатних середовищах. Отже, і у кислих 0 10 20 30 40 , хв
хлоридних розчинах з барботуванням СО 2, що Рис. 3. Зміна у часі густини струму
моделюють пластову воду, домінуючим анодного розчинення сталей 50Г (1)
чинником інтенсифікації корозії ферито- та 32Г2 (2) у МР (рН = 3,1) за
перлітних сталей є частка структурно-вільного потенціалу Еа = -0,1 В.
фериту у мікроструктурі.
На основі аналізу поляризаційних кривих сталі 32Г2 у МР з рН = 3,1–7,0
виявлено (рис. 4), що вона кородує з дифузійним контролем катодної реакції: без
пропускання СО 2 деполяризаторами є розчинений кисень, а з пропусканням –
додатково молекули H 2CO 3 та іони гідрокарбонату та водню, на які дисоціює
карбонатна кислота. Про наявність додаткового катодного деполяризатора свідчать
вищі катодні струми у МР з пропусканням СО 2, ніж без.
10 -3 10 -2 4
2 -3 5
lgі, А/см 2 10 -4 1 lgі, А/см 2 10 -4 3
10
10 -5 -5
10
10 -6 10 -6
-1,0 -0,8 -0,6 -0,4 Е, В -1,0 -0,8 -0,6 -0,4 Е, В
Рис. 4. Поляризаційні криві сталі 32Г2 у 1% NaCl без (1), з барботуванням СО2 (2–4) та
додатком СН3СООН (5) за рН: 1 – 7,0; 2 – 6,3; 3 – 5,1; 4 – 4,15; 5 – 3,1.
Зі зниженням рН розчину до 3,1 інтенсифікуються обидві електродні реакції
(рис. 4), а отже, зростає швидкість корозії сталі (рис. 5а). У МР з рН = 4,15–6,3
(пропускання СО 2) підвищення швидкості корозії сталі i corr зі зниженням рН
пропорційне зростанню швидкості катодної деполяризації і d (рис. 5б), а за додавання
СН 3СООН (рН = 3,1) таку залежність не фіксували, що вказує на її інтенсифікувальний