Page 14 - Microsoft Word - aref_Korniy_final.doc
P. 14
12
Встановлено, що надатомна адсорбція хлорид-іона існує лише на шарі міді
поверхні (100) кластера Al 2Cu, тоді як на алюмінії існує міцний зв'язок у містковому
положенні з енергією зв’язку 2,063 еВ. На поверхні (110) кластерів Al 2Cu та
Al 2CuMg найбільш енергетично вигідне положення хлорид-іона міжвузлове (Е b =
2,467 та 2,689 еВ відповідно). Тобто атоми магнію в кластері підвищують реакційну
здатність поверхні інтерметаліду до взаємодії з хлорид-іонами. Крім цього, під час
адсорбції хлорид-іона відбувається інтенсивніший перенос заряду на поверхню
кластера із пониженням його потенціалу іонізації (більш ніж у 1,5 рази), що свідчить
про зниження термодинамічної стійкості. Таким чином, поверхня (110)
інтерметаліду найбільш схильна до корозійного руйнування, що зумовлено, з одного
боку, її ступеневою будовою, а з іншого – вищою енергією зв’язку хлорид-іона на
ній порівняно із поверхнею (100).
–
Розрахунки взаємодії молекулярного комплексу Сl (H 2O) з кластерами
інтерметаліду за рівнянням (1) засвідчили, що водне середовище послаблює
адсорбційну здатність хлорид-іонів майже втричі на кластері (100) та вдвічі на
кластері (110) інтерметаліду. Отримані результати корелюють із даними газофазної
адсорбції хлор-іонів. На поверхні (110)Al 2Cu хлорид-іон у проміжному стані може
зв’язуватися із атомами міді в надатомному положенні, а перехід у стійке
міжвузлове положення відбувається з незначною енергією активації (≈ 0,15 eВ).
Встановлено меншу реакційну здатність гідроксид-іона на поверхні кластерів
інтерметалідів порівняно із хлорид-іоном (енергія зв’язку менша в 1,2–1,5 рази).
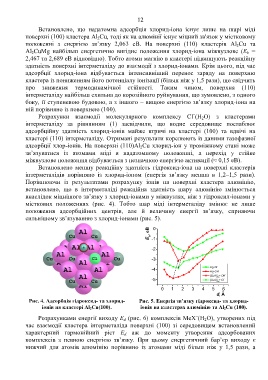
Порівнюючи із результатами розрахунку іонів на поверхні кластера алюмінію,
встановлено, що в інтерметаліді реакційна здатність шару алюмінію змінюється
внаслідок міцнішого зв’язку з хлорид-іонами у міжвузлях, ніж з гідроксил-іонами у
місткових положеннях (рис. 4). Тобто шар міді інтерметаліду змінює не лише
положення адсорбційних центрів, але й величину енергії зв’язку, сприяючи
сильнішому зв’язуванню з хлорид-іонами (рис. 5).
0
E b , eВ -1
-2
-3
Al +Cl -
-4 n -
Al +OH
n
(CuAl ) + OH -
2 n
-5 (CuAl ) + Cl -
2 n
0 1 2 3 4 5 6
o
d, A
Рис. 4. Адсорбція гідроксид- та хлорид- Рис. 5. Енергія зв’язку гідроксид- та хлорид-
іонів на кластері Al 2Cu(100). іонів на кластерах алюмінію та Al 2Cu (100).
–
Розрахунками енергії виходу E d (рис. 6) комплексів MeX (H 2O), утворених під
час взаємодії кластера інтерметаліда поверхні (100) зі середовищем встановлений
характерний гармонійний ріст E d аж до моменту утворення адсорбованих
комплексів з певною енергією зв’язку. При цьому енергетичний бар’єр виходу є
нижчий для атомів алюмінію порівняно із атомами міді більш ніж у 1,5 рази, а