Page 92 - 2
P. 92
91
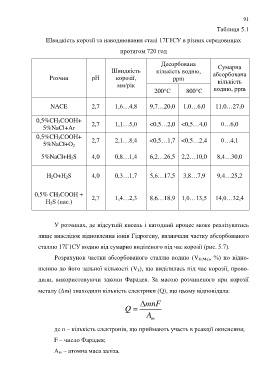
Таблиця 5.1
Швидкість корозії та наводнювання сталі 17Г1СУ в різних середовищах
протягом 720 год
Десорбована Сумарна
Швидкість кількість водню,
Розчин рН корозії, ppm абсорбована
кількість
мм/рік
200С 800С водню, ppm
NACE 2,7 1,6…4,8 9,7…20,0 1,0…6,0 11,0…27,0
0,5%CH 3COOH+ 2,7 1,1…5,0 <0,5…2,0 <0,5…4,0 0…6,0
5%NaCl+Ar
0,5%CH 3COOH+ 2,7 2,1…8,4 <0,5…1,7 <0,5…2,4 0…4,1
5%NaCl+O 2
5%NaCl+H 2S 4,0 0,8…1,4 6,2…26,5 2,2…10,0 8,4…30,0
H 2O+H 2S 4,0 0,3…1,7 5,6…17,5 3,8…7,9 9,4…25,2
0,5% CH 3COOH + 2,7 1,4…2,3 8,6…18,9 1,0…13,5 14,0…32,4
H 2S (нас.)
У розчинах, де відсутній кисень і катодний процес може реалізуватись
лише внаслідок відновлення іонів Гідрогену, визначали частку абсорбованого
сталлю 17Г1СУ водню від сумарно виділеного під час корозії (рис. 5.7).
Розрахунок частки абсорбованого сталлю водню (V Н(Ме), %) по відно-
шенню до його зальної кількості (V k), що виділилась під час корозії, прово-
дили, використовуючи закони Фарадея. За масою розчиненого при корозії
металу (m) знаходили кількість електрики (Q), що цьому відповідала:
mnF
Q
A m
де n – кількість електронів, що приймають участь в реакції окиснення;
F – число Фарадея;
A m – атомна маса заліза.